Článek je převzat ze serveru Homeopatické lékařské asociace
Očkování a jím navozená imunita jedince i kolektivu je jedním z nejefektivnějších způsobů prevence vzniku a šíření závažných infekčních onemocnění v populaci. Pokud je proočkovanost v populaci vysoká, lze hovořit o kolektivní imunitě. Ta brání v šíření původce a ochrání tak i neočkované jedince.
Složení vakcín:
- složky aktivně působící na imunitní systém (antigen + adjuvans)
- neaktivní složky ( stabilizátory, konzervanty, antibiotika)
Složky aktivně působící na imunitní systém
Antigen je substance, která navozuje žádanou imunitní reakci u očkované osoby.
Adjuvans je nespecificky působící komponenta zvyšující specifickou imunitní odpověď na antigen. Má účinek depotní a imunomodulační. Díky tomu je po očkování dlouhodobá protilátková odpověď.
Ideální adjuvans navozuje imunomodulaci ovlivněním cytokinů. Napomáhá rozpoznání, navození a udržování prezentace antigenu. Indukuje buněčnou imunitní odpověď cytotoxickými Tc lymfocyty. Stimuluje specifické Th1 a Th2 lymfocyty s následnou tvorbou identických klonů lymfocytů. Vytvoření depotního účinku vakcíny.
Neaktivní složky
Antibiotika se používají zejména při výrobě atenuovaných virových vakcín k eliminaci jakékoliv kontaminace mikroorganismy při výrobě, nejčastěji se používá kanamycin, neomycin.
Konzervanty se používají u více dávkového balení, používal se thiomersal. Od něj se upouští pro možné zvyšování hladiny rtuti v organismu.
Stabilizátory se používají pro zachování identických vlastností do výroby, přes transport až k samotné aplikaci vakcíny. Používá se sacharóza, chlorid hořečnatý, síran hořečnatý.
Rozdělení očkovacích látek
- Podle typu
- Živé, oslabené (atenuované)
- Inaktivované celobuněčné
- Toxoidy
- Subjednotkové
- Rekombinantní
- Podle druhu
- Monovalentní
- Polyvalentní (bi, tri, penta, hexavakcíny)
1. Živé, oslabené (atenuované) vakcíny
Např. MMR, TBC vakcína.
Základem je infekční původce s oslabenou virulencí, vyvolávají silný antigenní podnět. Zajišťují mnoholetou ochranu. Nevýhodou je možná reziduální patogeni-ta (problém u imunodeficientních pacientů), vyraznější veldejší učinky – lokální i celkové. Je nutné striktní dodržování chladového řetězce. K plné ochraně stačí většinou 1- 2 dávky.
2. Inaktivované celobuněčné vakcíny
Např. vakcína proti klíšťové encefalitidě, proti hepatitidě B.
Obsahuje bakterie nebo viry, které jsou chemicky nebo fyzikálně usmrceny a tím zbaveny schopnosti množení v organismu. Podmínkou je nepoškození povrcho-vých antigenů nutných k navození protektivní reakce. Jsou vysoce reaktogení, mívají často lokální i celkové příznaky běžné po očkování. Imunogenicita je nižší než u živých vakcín. K plné ochraně je nutné aplikovat 3-4 dávky.
3. Toxoidy
Např. tetanus.
Obsahuje bakteriální toxiny, které jsou zbaveny své toxicity teplem nebo formal-dehydem přičemž jsou zachovány imunizační schopnosti. Často se používají jako nosič v konjugovaných vakcínách ( vakcíny proti pneumokokům, meningokokům, hemofilům)
4. Subjednotkové vakcíny
Např. proti chřipce, proti pneumokokům
Obsahují pouze tu složku z patogenního mikroorganismu, která vyvolává protek-tivní imunitní odpověď. Odstraněním zbytečných komponent se sníží možné ne-žádoucí účinky.
5. Rekombinanntní vakcíny
Např. Očkování proti lidskému papilomaviru
Připraveny metodami molekulární biologie vložením příslušného genu kódujícího imunoprotektivní antigen do produkčního organismu. Vyprodukovaný antigen se purifikuje.
6. DNA a RNA vakcíny
Nové poznatky imunologie a molekulární biologie umožnily vývoj DNA a RNA vak-cín, majících široké možnosti uplatnění. U infekcí nebo nádorů lze jich užít k pre-venci i k terapii, uplatní se u autoimunních nemocí i alergie. Z hlediska techno-logií mohou sloužit k přípravě reagencií pro produkci monoklonálních i polyklo-nálních protilátek aj. Na rozdíl od živých atenuovaných vakcín jde při aplikaci DNA vakcíny pouze o přenos genů kódujících imunogenní antigeny. Vektory se samy nereplikují, ani u nich nedochází ke zvratu avirulence, protože obsahují jen poža-dované genetické sekvence. Jako vektory se používají adenoviry, rhinoviry. Tyto DNA a jiné na genech založené vakcíny by měly umožnit generování specifických imunitních reakcí ( cytolytických Tc -buněk, protilátek, požadovaného typu T-h buněk). Jejich schopnost navodit celulární i humorální odpověď může být rozho-dující při přípravě vakcín, které by byly efektivní proti virovým infekcím jako je HIV, coronavirus, intracelulárně uloženým bakteriím (např. TBC) a parazitům (např. malárii), stejně jako proti nádorům.
- Monovalentní vakcíny
Obsahuje pouze jeden imunogen – oslabený nebo subjednotkový.
- Konjugované vakcíny
Kromě imunogenu obsahují polypeptidy, které jsou k tomuto imunogenu che-micky vázány – konjugovanou vazbou – a nemají specifický imunogenní účinek. Jsou ale schopny stimulovat T buňky a produkci lymfokinů potřebných pro aktiva-ci B buněk.
- Polyvalentní vakcíny
Vývoj od 70. let minulého století. Obsahují více než jednu složku. Např. kombi-novaná vakcína očkování proti záškrtu, tetanu černému kašli. Kombinace se volí dle synergického účinku jednotlivých agens na imunitní systém. Sníží se tím spo-třeba adjuvancií.
Vakcíny proti SARS-COV-2
V současné době se v klinickém hodnocení nachází 52 vakcín a 162 kandidátních vakcín.
Podmínečnou registraci Evropské komise získaly již dvě mRNA vakcíny: vakcína Comirnaty (Pfizer -BioNTech COVID-19 Vaccine) a COVID-19 VACCINE MODERNA.
Obě vakcíny fungují na stejném principu- obsahují messenger molekulu RNA (mRNA), která nese instrukce pro produkci spike proteinu. To je protein, který se vyskytuje na povrchu viru SARS-COV-2 a je potřebný pro to, aby byl virus schopen vstoupit do buněk. Jakmile je podána vakcína lidem, některé jejich buňky přečtou instrukce obsažené v mRNA a dočasně produkují tento spike protein. Imunitní systém člověka protein rozpozná jako cizí a začne tvořit protilátky a akti-vovat T buňky. mRNA z vakcíny přitom nezůstane v těle, ale je krátce po vakcina-ci rozložena, nedochází tedy k žádnému ovlivňování DNA lidských buněk.
Aby byly krátké řetězce mRNA uchráněny před degradací dříve, než jsou inkorpo-rovány do cílových buněk, jsou „zabaleny do syntetických lipidů a nevyžadují už použití adjuvancia. Právě nestabilita je příčinou nutnosti transportu a uchovávání vakcíny při nízkých teplotách ve zmrazeném stavu.
Očkovací látka Comirnaty je určena pro osoby ve věku 16 let a starší, očkovací látka Moderna je určena pro osoby ve věku 18 let a starší.
Účinnost
Obě vakcíny jsou dvoudávkové, v klinických studiích prokázaly velmi vysokou účinnost 94-95% v prevenci symptomatické nákazy, a to po 7-14 dnech od podání druhé dávky.
Doba ochrany poskytovaná vakcínami zatím není známa, je stále hodnocena v probíhajících klinických studiích.
Ani u jedné z vakcín zatím není jasné, zda může bránit asymptomatické infekci vi-rem SARS-COV-2 . Studie této otázky dále probíhají.
Vedlejší účinky
U obou vakcín se v průběhu podávání v klinických studiích projevila řada vedlejších účinků, které byly mírné nebo střední a odezněly během několika dnů po vakcinaci. Častěji se vázaly k podání druhé dávky.
Mezi nejčastější nežádoucí účinky vakcíny Comirnaty patří bolest a zduření v místě vpichu, únava, bolest hlavy, svalů a kloubů, zimnice a horečka. U vakcíny Comirnaty bylo zaznamenáno také několik případů alergických reakcí, nejčastěji u lidí, kteří měli dřívější problémy s alergiemi
Mezi nejčastější nežádoucí účinky vakcíny Moderna patří bolest a zduření v místě vpichu, únava, zimnice, horečka, otok nebo citlivost lymfatických uzlin v podpaží, bolesti hlavy, svalů a kloubů, nauzea a zvracení.
Zatím neexistují žádné důkazy, že by podání obou vakcín bylo spojené s některými závažnými nežádoucími účinky.
Ani jedna z vakcín nebyla testována ve skupinách těhotných a kojících žen. Podá-vání vakcín v těhotenství se má zvážit pouze v případě, pokud možné přínosy pře-váží jakákoli potenciální rizika pro matku a plod.
Možná aplikace 14 dnů po předchozím očkování neživými vakcínami, měsíc po očkování živými vakcínami.
Nutno dodržet 3 měsíční odstup u pacientů po podání rekombinantní plasmy.
Nedoporučuje se očkovat souběžně s jinými vakcínami.
Obě vakcíny získaly podmínečnou registraci v EU a podléhají dalšímu sledování, Všechna podezření na nežádoucí účinky jsou shromažďovány prostředictvím far-makovigilančních hlášení na SÚKL a předávány do farmakovigilančního systému EU. To umožní získání nových informací a doplnění jejich bezpečnostního profilu.
Zatím dle informací mých už naočkovaných kolegů očkování probíhá bez kompli-kací. Všichni z mého okolí měli pouze mírnou bolestivost v místě vpichu, bez otoku či zarudnutí s dobrou reakcí na lék Ledum palustre.
U alergických pacientů doporučejeme preventivní podání antihistaminik.
Naše zkušenosti
Zatím máme naočkováno cca 400 zaměstnanců-zdravotníků první dávkou Comir-naty. 1 suspektní alergická reakce, ošetřena na ambulanci, 2 x následná pozitivita PCR testu, uzavřeno jako očkování v inkubační době.
Nejčastější nežádoucí účinky: bolest v místě aplikace, bolesti, únava.
Důraz kladen na bezpečnost – anafylaktoidní reakce se vyskytují častěji než u jji-ných očkování. Zvažuje se možná reakce na polyethylenglykol, neboť tuto látku jiné vakcíny neobsahují. Během ledna plánujeme zavést vyšetření u rizikových pacientů na přecitlivělost na tuto látku.
Preventivní podání antihistaminik u rizikových pacientů se jeví lepším řešením než závažná alergická reakce.
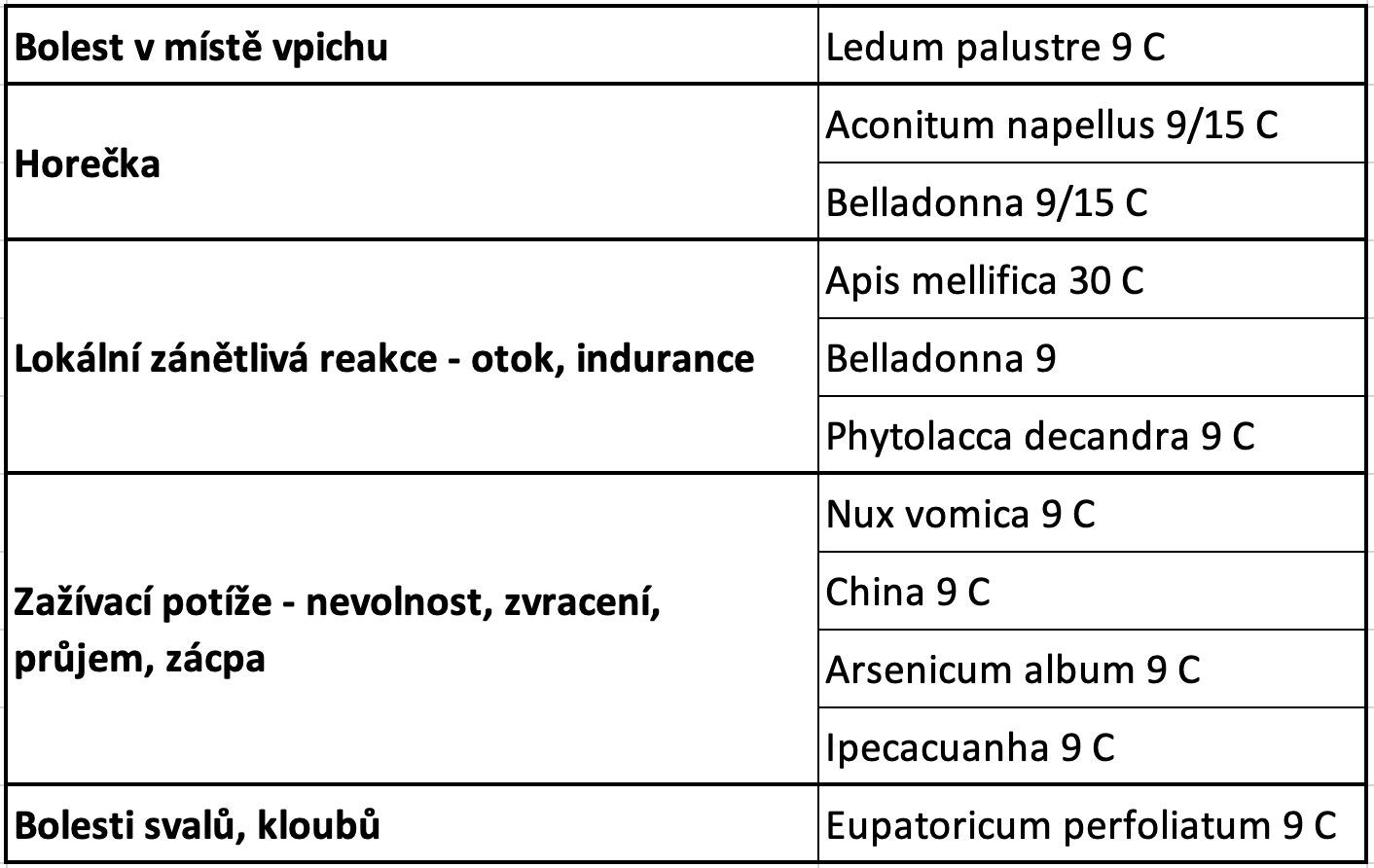
Homeopatické léky používané při očkování jsou Thuya occidentalis 15 C 1x denně 5 granulí 7 dnů po očkování, podáváme systematicky u všech. Při bolesti v místě vpichu Ledum Palustre 9 C 2x denně 5 granulí do odeznění potíží. Většinou stačily 2-3 dávky. Při celkových potížích jako je horečka, bolesti svalů a kloubů možno použít léky Belladonna a Eupatorium perfoliatum 9 C 2-3x denně 5 granulí dle potíží.
HOMEOPATIE A OČKOVÁNÍ – zmírnění vedlejších účinků
Systematicky Thuya 15 C 1x denně 5 granulí, u alergiků a ekzematiků podáváme raději u kteréhokoliv očkování lék Okoubaka aubrevillei 9 C 1x denně 5 granulí 7 dnů po očkování.